Wasser ist, rein wissenschaftlich betrachtet, eine chemische Verbindung aus den Elementen Sauerstoff (O) und Wasserstoff (H). Die chemische Formel des sogenannten Wassermoleküls lautet H2O. Fachsprachlich korrekt ausgedrückt würde man Wasser auch als Dihydrogenmonoxid bezeichnen, nach der sogenannten IUPAC-Nomenklatur als Oxidan. Es ist klar, farb- und geruchlos. Sein Siedepunkt liegt bei 100 Grad Celsius, sein Schmelzpunkt bei 0 Grad Celsius Klingt erst einmal recht langweilig, ist es aber nicht.

Wasser ist viel spannender, als es auf den ersten Blick erscheint. Es umgibt uns tagtäglich und stellt die Grundlage unseres Lebens dar. Beim Duschen, Kochen oder Eisessen nimmt man seine Besonderheiten meist gar nicht mehr wahr. Doch in seinen unterschiedlichen Formen verursacht das vielfältige Molekül eindrückliche Phänomene.
Es kommt gasförmig in der Luft in Form von unsichtbarem Wasserdampf vor. Seine flüssige Form ist auf der Erde allgegenwärtig: rund 70% unserer Erde sind von Ozeanen, Flüssen und Seen bedeckt. In seiner festen Form tritt Wasser als Eis, Schnee, Hagel und Graupel oder Reif auf. Es kommt also in allen drei Aggregatzuständen auf der Erde vor. Dies mag vielleicht nicht einzigartig sein, aber dennoch gibt es keinen anderen Stoff, der uns in allen drei Zuständen so präsent ist.
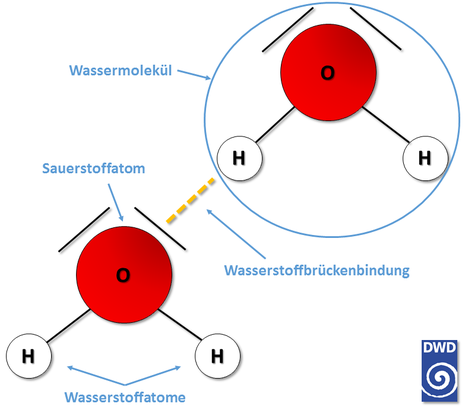
Ein weiteres, seltsam anmutendes Phänomen ist die sogenannte "Dichteanomalie". Diese sorgt dafür, dass gefrorenes Wasser auf seinen flüssigen Nachbarmolekülen schwimmt. In der Regel nimmt die Dichte der meisten Stoffe mit zunehmender Temperatur ab – unabhängig vom Aggregatszustand. Anders ist es beim Wasser: Die höchste Dichte besitzt Wasser bei etwa 4 Grad Celsius unter Normaldruck. Dann wiegt ein Liter Wasser ein Kilogramm. Wird das Wasser nun erhitzt, dehnt es sich aus und wird in der Folge leichter. Die besondere Eigenschaft des Wassers: Sinkt die Temperatur unter 4 Grad, wird Wasser ebenfalls wieder leichter und dehnt sich aus – selbst beim Wechsel in den festen Aggregatszustand. Der Grund für diese Besonderheit liegt in der Verkettung der Sauerstoff- und Wasserstoffatome benachbarter Wassermoleküle, also in den Kräften, die die verschiedenen Wassermoleküle untereinander zusammenhalten. Diese werden, ohne hier zu ausführlich in die Tiefen der Chemie eintauchen zu wollen, als sogenannte Wasserstoffbrückenbindungen bezeichnet. Nur so viel sei gesagt: Ohne diese Wasserstoffbrückenbindungen würde Wasser in seiner uns bekannten Form auf der Erde nicht existieren. Und ohne diese besondere Eigenschaft hätte sich folglich kein Leben auf der Erde entwickelt.


Eine eher paradoxe Eigenschaft des Wassers stellt der sogenannte Mpemba-Effekt dar. Dieser beschreibt ein Phänomen, bei dem heißes Wasser unter geeigneten Bedingungen schneller gefriert als kaltes Wasser. Dies widerspricht ein Stück weit der eigenen Intuition. Einen ausführlichen Artikel meines Kollegen Sebastian Altnau vom 19. Februar 2021 zu diesem außergewöhnlichen Effekt finden Sie im Tagesthemen-Archiv (https://www.dwd.de/DE/wetter/thema_des_tages/2021/2/19.html).
Wasser besitzt darüber hinaus eine hohe spezifische Wärmekapazität. Oder einfacher ausgedrückt: Wasser kann viel Energie aufnehmen, d.h. um Wasser zu erhitzen wird viel Energie benötigt. Insgesamt sind für die Erwärmung eines Kilogramms um 1 Grad 4200 Joule an thermischer Energie notwendig. Um beispielsweise die Temperatur des gesamten Bodensees um 10 Grad zu erhöhen - immerhin besteht dieser aus 48 Billionen Litern Wasser - wären mehr als 2 Trillionen Joule (entspricht circa 558 Terrawattstunden) notwendig. Wie groß diese Energiemenge ist, zeigt sich im Vergleich zum Stromverbrauch in Deutschland, der im Jahr 2021 bei 508 Terrawattstunden lag. Die Energie, die für die Erwärmung des Bodensees notwendig wäre, könnte Deutschland also für mehr als ein ganzes Jahr (sofern sich der Autor in den Potenzen nicht verrechnet hat) mit Strom versorgen.
Wasser besitzt noch viele weitere physikalische Eigenschaften, die einiges an Spannung bieten, wie dem kühlenden Effekt beim Schwitzen oder seiner besonders starken Oberflächenspannung. Suchen Sie doch einfach mal in den Weiten des Internets. Dort werden Sie sicherlich fündig. Wie wichtig Wasser für unser Wetter ist, wird in einem weiteren Thema des Tages in den nächsten Wochen thematisiert.





